核酸探针
百科内容来自于:

原理
种类
按性质划分
作为诊断试剂,较常使用的是基因组DNA探针和cDNA探针。其中,前者应用最为广泛,它的制备可通过酶切或聚合酶链反应(PCR)从基因组中获得特异的DNA后将其克隆到质粒或噬菌体载体中,随着质粒的复制或噬菌体的增殖而获得大量高纯度的DNA探针。将 RNA进行反转录,所获得的产物即为cDNA。cDNA探针适用于RNA病毒的检测。cDNA探针序列也可克隆到质粒或噬菌体中,以便大量制备。
将信息RNA(mRNA)标记也可作为核酸分子杂交的探针。但由于来源极不方便,且RNA极易被环境中大量存在的核酸酶所降解,操作不便,因此应用较少。
用人工合成的寡聚核苷酸片段做为核酸杂交探针应用十分广泛,可根据需要随心所欲合成相应的序列,可合成仅有几十个bp的探针序列,对于检测点突变和小段碱基的缺失或插入尤为适用
按标记物划分
有放射性标记探针和非放射性标记探针两大类。放射性标记探针用放射性同位素做为标记物。放射性同位素是最早使用,也是目前应用最广泛的探针标记物。常用的同位素有32P、3H、35S。其中,以32P应用最普遍。放射性标记的优点是灵敏度高,可以检测到Pg级;缺点是易造成放射性污染,同位素半衰期短、不稳定、成本高等。因此,放射性标记的探针不能实现商品化。目前,许多实验室都致力于发展非放射性标记的探针。
标记
放射性标记法
常将放射性同位素如32 P连接到某种脱氧核糖核苷三磷酸(dNTP)上做为标记物,然后通过切口平移法标记探针。
切口平移法(nick translation)是利用大肠杆菌DNA聚合酶I (E.coli DNA polymerase I) 的多种酶促活性将标记的dNTP掺入到新形成的DNA链中去,形成均匀标记的高比活DNA探针。其操作方法如下:
⑴取1?g DNA溶于少量无菌双蒸水中,加入5?l距离大约10×切口平移缓冲液 (0.5mol/L Tris-HCl,PH7.2;0.1 mol/L MgSO4 ;1mmol/L二硫苏糖醇;500?g/mL牛血清白蛋白),加入除标记物(如?-32 p-dATP)外的其它三种dNTP(如dCTP,dGTP,dTTP)溶液,20mmol/L溶液各1?l。
⑵加入100?ci(10?l)标记物溶液,加入无菌双蒸水至终体积为46.5?l,混匀,加入0.5?l稀释的DNaseI溶液,混匀;加入1?l(约5单位)E.coli DNA polymerase I,混匀。
⑶置14-16℃反应1-2小时。
非放射性标记法
可将生物素、地高辛连接在dNTP上,然后象放射性标记一样用酶促聚合法掺入到核酸链中制备标记探针。也可让生物素、地高辛等直接与核酸进行化学反应而连接上核酸链。其中,生物素的光化学标记法较为常用。其原理是利用能被可见光激活的生物素衍生物-光敏生物素(photobiotin),光敏生物素与核酸探针混合后,在强的可见光照射下,可与核酸共价相连,形成生物素标记的核酸探针。可适用于单、双链DNA及RNA的标记,探针可在-20℃下保存8-10个月以上。具体操作方法如下:
⑴将双链DNA变性或用NaOH处理形成缺口,单链DNA或RNA毋需处理,将核酸样品溶于水。
⑵暗室下在微量离心管中加入10?g DNA,1mg/ml光敏生物素20?l,加水至50?l,混匀。
⑶冰浴中打开离心管盖,在300-500瓦灯下照射10分钟(液面距灯泡10cm)。
⑷加入100?l 0.1mol/L Tris-HCl,pH8.0,加入100?l 2-丁醇抽提两次,离心,弃上层。
⑸乙醇沉淀核酸探针;用70%乙醇漂洗真空抽干,备用。
除上述标记法外,探针的制备和标记还可通过PCR反应直接完成。
核酸杂交
杂交技术有固相杂交和液相杂交之分。固相杂交技术较为常用,先将待测核酸结合到一定的固相支持物上,再与液相中的标记探针进行杂交。固相支持物常用硝酸纤维素膜(nitrocellulose filter membrane,简称NC膜)或尼龙膜(nylon membrane)。
用探针对细胞或组织切片中的核酸杂交并进行检测的方法称之为核酸原位杂交。某特点是靶分子固定在细胞中,细胞固定在载玻片上,以固定的细胞代替纯化的核酸,然后将载玻片浸入溶有探针的溶液里,探针进入组织细胞与靶分子杂交,而靶分子仍固定在细胞内。例如。可用特异性的细菌、病毒的核酸做为探针对组织、细胞进行原位杂交,以确定有无该病原体的感染等。原位杂交不需从组织中提取核酸,对于组织中含量极低的靶序列有极高的敏感性,在临床应用上有独特的意义。
印迹技术
斑点印迹
(Dot-blot) 将待测核酸样品变性后直接点样在膜上,称之为斑点印迹。为使核酸牢固结合在膜上,通常还将点样后的膜进行80℃真空烘烤2h。
应用斑点印迹技术,可在一张膜上同时进行多个样品的检测,操作简便、快速,在临床诊断中应用较广。适合进行特定基因的定性及定量研究,但不能鉴定所测基因的分子量。
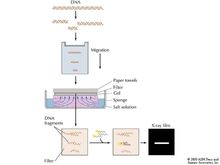
Southern印迹
(Southern blot) 这是指将DNA片段经琼脂糖凝胶电泳分离后转移到固相支持物上的过程。
常规处理如下,先用限制性内切酶对DNA样品进行酶切处理,经琼脂糖凝胶电泳将所得DNA片段按分子量大小分离,接着对凝胶进行变性处理,使双链DNA解离成单链,并将其转移到NC膜或其它固相支持物上,转移后各DNA片段的相对位置保持不变。用探针与经Southern印迹处理的DNA样品杂交,可鉴定待测DNA的大小、进行克隆基因的酶切图谱分析、基因组基因的定性及定量分析、基因突变分析及限制性片段长度多态性分析(RFLP)等。
Southern印迹的操作方法有三种:
毛细管转移
(或虹吸印迹)。这是一传统方法,进行毛细管转移时,DNA片段由液流携带从凝胶转移到固相支持物表面。安放装置时,在转移槽中央的平台上由下到上依次叠放变性凝胶、滤膜、一叠干的吸水纸巾;凝胶与转移缓冲液通过一纸桥连接;滤膜上的纸巾吸水而产生并维持毛细管作用,液体由于毛细管作用抽吸通过凝胶,并将DNA片段携带聚集在滤膜上。DNA片段的大小和琼脂的浓度决定了转移的速度。小片段DNA(<1kb)在1小时内可从 0.7%琼脂糖凝胶上几乎定量转移,而大片段DNA的转移较慢且效率较低,如大于15kb的 DNA片段需要18小时而转移尚不完全。
电转移
利用电场的电泳作用将凝胶中的DNA转移到固相支持物上,可达到简单、迅速、高效的目的。一般2-3小时内可转移完毕。电转法不宜采用NC膜,因为NC膜结合 DNA依赖高盐溶液,而高盐溶液在电泳过程中会破坏缓冲体系,使DNA损伤。一般使用化学活化膜和正电荷修饰的尼龙膜。此外,电转过程中转移体系的温度升高,必须使用循环冷却水。商业化的电转仪一般附有冷却设备,也可在冷室中进行。具体操作时,按仪器使用说明安装电转装置,将变性凝胶夹在转移膜内平行电极内侧的多孔板之间,排除夹层间气泡,加入转移缓冲液并通电进行电转。
真空印迹法
这是近年来发展起来的一种简单、快速、高效的DNA和RNA印迹法。其基本原理是利用真空作用将转膜缓冲液从凝胶上层的容器抽到下层,凝胶中的核酸片段将随缓冲液移置到凝胶下面的固相支持物上。这一方法的最大优点是快速高效,可在转膜的同时进行DNA的变性与中和,30分钟至1小时可完成,适合检疫工作的要求。已有商业化的真空转移仪提供,可按商品使用说明进行操作。
Southern印迹后的滤膜仍需进行固定处理,对NC膜可用80℃真空烘烤2小时,对尼龙膜还可用短波紫外线(波长254nm)照射几分钟。
Northern印迹
杂交反应
杂交反应包括预杂交、杂交和漂洗几步操作。
预杂交
预杂交的目的是用非特异性DNA分子(鲑精DNA或小牛胸腺DNA)及其它高分子化合物(Denhart’s溶液)将待测核酸分子中的非特异性位点封闭,以避免这些位点与探针的非特异性结合。杂交反应是使单链核酸探针与固定在膜上的待测核酸单链在一定温度和条件下进行复性反应的过程。杂交反应结束后,应进行洗膜处理以洗去非特异性杂交以及未杂交的标记探针,以避免干扰特异性杂交信号的检测。膜洗净后,将继续进行杂交信号的检测。
⑴以放射性标记探针与固定在NC膜上的核酸进行杂交为例,杂交反应操作如下:
① 配制所需试剂
SSC溶液(20×):3mol/L NaCl,0.3mol/L柠檬酸钠。
Denhardt’s溶液(50×):聚蔗糖5g,聚乙烯吡咯烷酮5g,牛血清白蛋白(BSA)5g加水至500ml。
预杂交液:6×SSC,5×Denhardt’s溶液,0.5%SDS,100?g/ml经变性或断裂成片段的鲑精DNA。
② 将含靶核酸的NC膜漂浮于6×SSC液面,使其由下至上完全湿润,并继续浸泡2分钟。
③ 将湿润NC膜装入塑料袋中,按0.2ml/cm2的量加入预杂交液,尽可能挤出气泡,将袋封口,置68℃水浴1-2小时或过夜。
④ 将双链探针做变性处理使成单链,即于100℃加热5分钟,然后立即置冰浴使骤冷。
⑤ 从水浴中取出杂交袋,剪去一角,将单链探针加入,尽可能将袋内空气挤出去,重新封口,并将杂交袋装入另一个干净的袋内,封闭,以防放射性污染。
⑥ 将杂交袋浸入68℃水浴,温育8-16小时。
⑦ 取出杂交袋,剪开,取出滤膜迅速浸泡于大量2×SSC和0.5%SDS中,室温振荡5分钟,勿使滤膜干燥。
⑧ 将NC膜移入盛有大量2×SSC和0.1%SDS溶液的容器中,室温漂洗15分钟。
⑨ 将NC膜移入一盛有大量0.1×SSC和0.5%SDS溶液的容器中,37℃漂洗30分钟至1小时。
⑩ 将NC膜移入一盛有新配0.1×SSC和0.5%SDS溶液的容器中,68℃漂洗30分钟至1小时。
⑾取出滤膜,用0.1×SSC室温稍稍漂洗,然后置滤纸上吸去大部分液体,待做杂交信号的检测。
杂交信号的检测
当探针是放射性标记时,杂交信号的检测通过放射自显影进行。即利用放射线在X光片上的成影作用来检测杂交信号。操作时,在暗室内将滤膜与增感屏、X光片依序放置暗盒中,再将暗盒置-70℃曝光适当时间,取出X光片,进行显影和定影处理。
应用
核酸探针技术是目前分子生物学中应用最广泛的技术之一,是定性或定量检测特异RNA或DNA序列的有力工具。核酸探针可用以检测任何特定病原微生物,并能鉴别密切相关的毒 (菌)株和寄生虫。目前,各种常见病毒病的诊断和研究都已应用到核酸探针技术,这方面的研究报道数以万计且与日俱增。但该项技术的操作毕竟比常规方法复杂,费用较高,在动物检疫中尚未推广。多在实验室内对病原作深入研究时使用。
$firstVoiceSent
- 来自原声例句